
2017年8月2日,美国食品和药物管理局(FDA)扩大了Imbruvica(伊布替尼)的应用范围,批准用于治疗一项或多项治疗失败后的慢性移植物抗宿主病(cGVHD)的成年患者。此次批准伊布替尼是首个也是唯一获得FDA批准的治疗cGVHD成人患者药物。而cGVHD也是伊布替尼在肿瘤治疗领域之外的首个适应症。
cGVHD是由于移植物的抗宿主反应而引起的一种免疫性疾病,是异基因造血干细胞移植的主要并发症和造成死亡的主要原因。GVHD患者最常见的受累器官为皮肤、胃肠道和肝脏。在伊布替尼获批之前,没有治疗GVHD的药物上市。临床上,大多数患者采用糖皮质激素治疗,长期使用会导致严重的健康并发症。
该批准是基于一项名叫PCYC-1129的开放标签、多中心、单臂、临床 Ib / II试验结果,该试验评估了伊布替尼在42例糖皮质激素一线治疗失败的cGVHD患者中的安全性和有效性。在研究人群中,导致移植的最常见的恶性肿瘤是急性淋巴细胞白血病(ALL),急性骨髓性白血病(AML)和慢性淋巴细胞性白血病(CLL)。cGVHD诊断中位数为14个月,60%的患者的Karnofsky性能评分为≤80。大多数患者(88%)在试验开始时至少有两个器官受损,最常见的器官是口腔(86%),皮肤(81%)和胃肠道(33%)。基线时,除了全身性糖皮质激素外,22%的患者正在接受免疫抑制剂治疗。
研究结果显示,总缓解率(ORR)为67%,21%的患者达到完全缓解(CR);45%达到部分缓解(PR)。缓解持续时间至少20周的患者比例为48%。在横跨所有受累器官中都观察到了相似的缓解率,多器官受累的患者中观察到多个器官都达到缓解。在整个研究过程中,达到缓解的患者中大部分实现了临床意义的症状改善、同时糖皮质激素剂量降低至最低可接受水平。
在美国,迄今为止,FDA已批准伊布替尼6个适应症,包括:慢性淋巴细胞白血病(CLL)、小淋巴细胞淋巴瘤(SLL)、华氏巨球蛋白血症(WM)和套细胞淋巴瘤(MCL)、边缘区淋巴瘤(MZL)以及最新获批的慢性移植物抗宿主病(cGVHD)。值得一提的是,伊布替尼除了是首个治疗cGVHD的药物之外,也是首个治疗MZL和WM的药物。
如需了解更多淋巴瘤的前沿信息 请扫描二维码访问“淋巴瘤亿刻”网站。

 热门推荐
MORE
热门推荐
MORE

专家“亿”周谈——直击伊布替尼,纵观CLL治疗从免疫化疗到个体化靶向疗法的革新
07-09
J HEMATOL ONCOL:前瞻性研究预测伊布替尼治疗过程中房颤的发生
07-19
CANCER CHEMOTH PHARM :PH调节剂奥美拉唑对伊布替尼影响几何?
08-08
以数据为准绳,中国新药亟需更多原始创新!——首创BTK抑制剂伊布替尼原研专家潘峥婴专访
09-30
欧洲血液学杂志:TEC与BTK抑制剂出血副作用无关
10-22
2018年IWWM 会议现场直达:伊布替尼治疗华氏巨球蛋白血症突破性进展!
11-02
专家“亿”周谈—— J CLIN ONCOL:伊布替尼单药治疗症状型/初治型华氏巨球蛋白血症的最新突破
04-09
BLOOD:基于伊布替尼的联合方案治疗复发/难治CNS淋巴瘤效果显著
05-14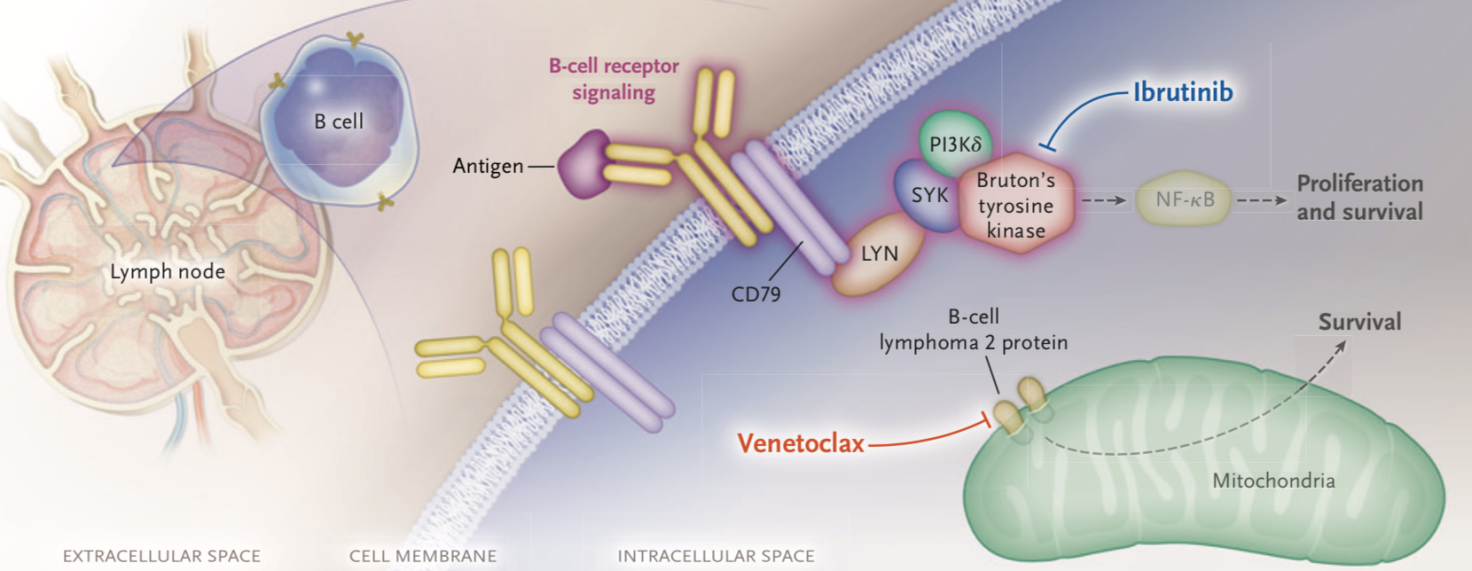
专家“亿”周谈——NEJM:伊布替尼联合维奈托克一线治疗慢性淋巴细胞白血病
06-12
【2019 ICML】黄慧强教授点评:IR联合短疗程R-HYPERCVAD / MTX在初治年轻MCL患者中有效性显著
06-20
【2019 EHA】纵览伊布替尼联合用药进一步提升CLL疗效
06-24
【2019 ICML】邱录贵教授点评:伊布替尼治疗华氏巨球蛋白血症的最新进展
06-25
【2019 ICML】张会来教授点评:伊布替尼联合利妥昔单抗治疗MCL疗效显著
06-25
【2019 ICML & EHA 回顾】中外专家畅谈伊布替尼治疗淋巴瘤的前沿进展
07-09Copyright 2008-2019 梅斯(MedSci)备案号 沪ICP备14018916号-1
