

背景介绍
慢性淋巴细胞白血病(CLL)是西方国家中最常见的成人白血病,在美国,每10万人发病约4.7例,相当于每年新增约20,100例。CLL以男性为主(约2:1),中位年龄为70至72岁。CLL由肿瘤B淋巴细胞的单克隆扩增引起,其免疫表型特征为CD5、CD19、CD20和CD23表达,而这些细胞表面蛋白在非恶性B细胞中无表达或低表达,同时这些单克隆扩增细胞在血液、次级淋巴组织和骨髓中广泛累积。小淋巴细胞淋巴瘤(SLL)与CLL有相似的组织形态学和免疫学特征,但缺乏白血病相(即每μl血液中含有少于5000个单克隆B细胞)。CLL临床异质性大,一部分患者诊断后长期随访病情稳定,甚至终身无治疗指证而无需治疗;但大部分患者在诊断时或随访中出现治疗指证而需要治疗。近日,淋巴瘤领域著名学者Burger, Jan A于Nature Reviews Clinical Oncology(影响因子20.693)发表的综述详细介绍了CLL的生物学特征、治疗方法沿革以及靶向疗法的优势。
CLL治疗方式演变
20世纪40年代
在这个时代,糖皮质激素是首个治疗CLL患者的系统疗法。由于明显的不良反应如感染等,糖皮质激素未被纳入标准治疗规范中。但是,大剂量糖皮质激素±CD20单抗仍可在难治CLL中获得一定的缓解率
20世纪50年代
氮芥衍生物开始用于CLL患者的治疗,鉴于作用机制(通过烷基与DNA的鸟嘌呤碱基连接而造成DNA损伤),这类药物也被称为烷化剂。直到现在,苯丁酸氮芥、环磷酰胺、苯达莫司汀等烷化剂,特别是与抗CD20抗体联合仍是CLL患者的标准疗法。在过去的5年中,苯丁酸氮芥和抗CD20抗体(利妥昔单抗或奥法木单抗)的组合在PFS方面优于苯丁酸氮芥单一疗法(CLL11、COMPLEMENT-1研究)。
20世纪90年代
核苷类似物(氟达拉滨、克拉屈滨和喷司他丁)的疗效在CLL患者中得到广泛研究。其中氟达拉滨的应用最为广泛,且能产生更高的ORRs。然而,从药物作用机理来看,核苷类似物掺入到DNA和RNA中会干扰分裂和非分裂细胞中的DNA合成、修复及表达。由此可见,核苷类似物对淋巴细胞清除不仅表现在清除CLL细胞上,也可清除非恶性T细胞,因此使用该类药物治疗的患者通常需检测免疫抑制状况。随后,氟达拉滨联合环磷酰胺(FC方案)具有协同作用,相比氟达拉滨单药有更高的反应率(ORRs、CR)和更长的无治疗生存时间(TFS)。
21世纪初
免疫化疗时代利妥昔单抗的出现,其联合氟达拉滨、环磷酰胺(FCR方案)将CLL治疗从化疗转变为化学免疫治疗时代。CLL8是比较FCR和FC方案一线治疗CLL的III期随机研究,本研究中, FCR相比较FC方案首次获得OS受益;然而亚组分析显示,FCR在高危CLL(17p-、11q-和IgHV无突变)中持续反应时间短(DOR),OS明显低于IgHV突变及其他低危CLL,因此,该方案多用于治疗低危患者,其研究方向主要集中在在获得微小残留病灶(MRD)同时,减少化疗周期数以减少毒性及转化风险。而CLL10研究得出, BR方案(苯达莫司汀联合利妥昔单抗)相比较FCR方案,PFS较短,但OS与FCR 方案相近,且感染等不良反应较少,因而BR方案更适用于接收骨髓抑制程度较低的一部分患者中。
新药及新型治疗时代
2010年以来,SYK抑制剂fostamatinib,PI3K抑制剂idelalisib,BTKi伊布替尼相继问世,使CLL治疗进入了突破性年代。2016年,BCL-2拮抗剂venetoclax被批准用于复发/难治CLL患者的治疗。此外,基于前期2017年研究中令人振奋的结果,CAR-T细胞疗法被认为在不远未来可被广泛应用于CLL治疗(图1)。
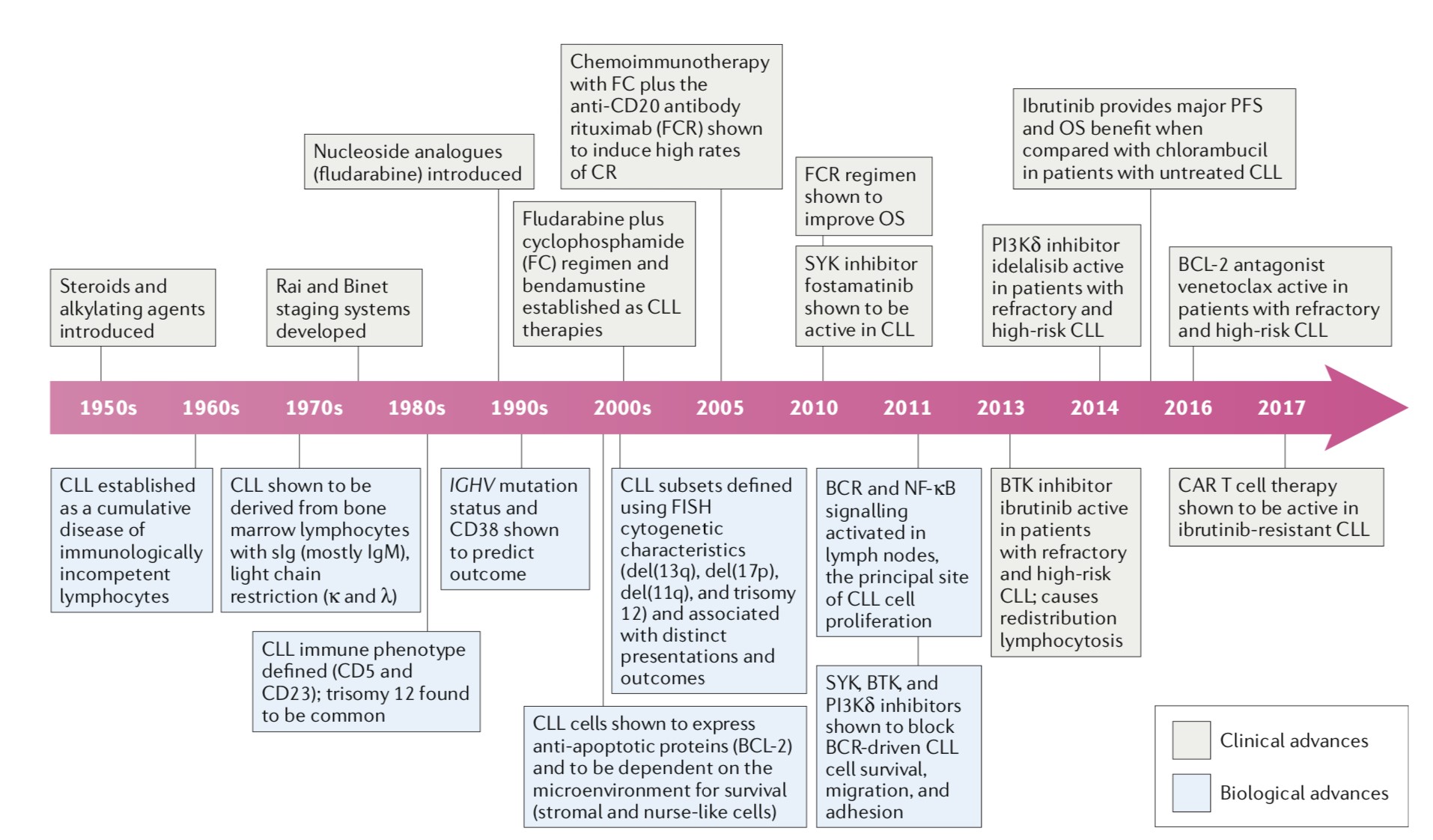
图1. CLL治疗和生物学阐释的历史沿革
BCR通路与CLL的关系
CLL细胞在次级淋巴器官中增殖,形成特征性增殖中心,在这些增殖中心里CLL细胞与一系列非恶性细胞共同构成了组织微环境(图2),如单核细胞来源的Nurse样细胞(NLCs)、T辅助细胞(图2)。
B细胞受体(BCR)的激活和信号传导影响CLL细胞增殖和存活。当BCR与可溶性抗原结合后,BCR信号在次级淋巴器官中被选择性激活,三种主要激酶SYK、BTK和PI3K募集于细胞膜。1. 在CLL细胞中高表达的抗凋亡蛋白(BCL-2)也参与SYK、BTK和PI3K介导的CLL细胞的增殖与存活;2. 其他微环境因子包括由NLCs产生的B细胞活化因子(BAFF,也称为TNFSF13B)和增殖诱导配体(APRIL,也称为TNFSF13)有助于CLL增殖与存活;3. 活化的T辅助细胞能够表达CD40配体,其可通过与CD40(也称为TNFRSF5)结合来促进CLL细胞的生长;4. 除此之外,NLCs和其他基质细胞还能分泌趋化因子(CXCs),如CXCL13和CXCL12,CXCs可通过激活位于CLL细胞的CXCR5和CXCR4来发挥生物学作用(图2)。
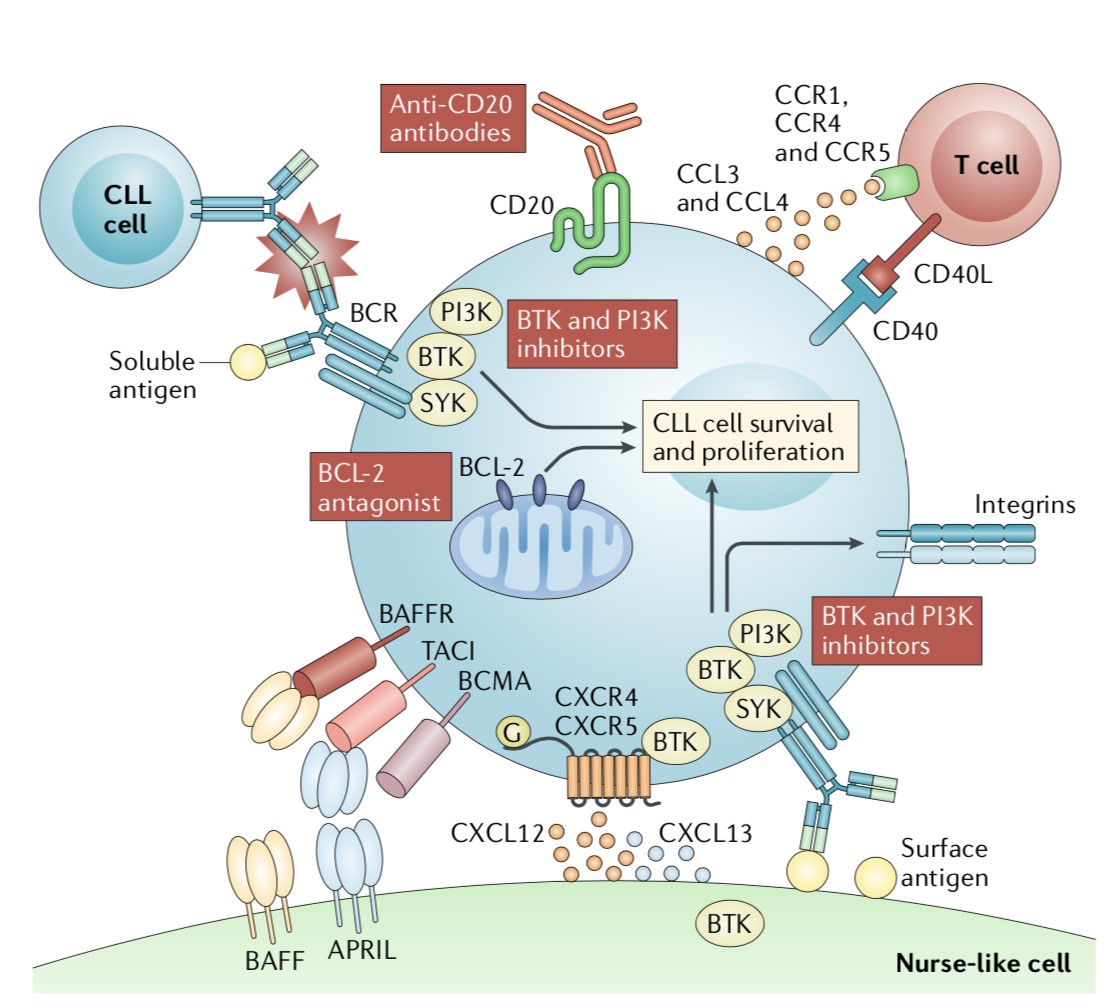
图2. CLL细胞与一系列非恶性细胞共同构成的组织微环境
BCR激活后,BCR复合物相关蛋白-α(Igα)和-β(Igβ)的胞内段尾部基序被激活,然后SYK被招募到Igβ的尾部基序并被活化,进而活化的SYK招募并活化PI3K,活化的PI3K产生磷脂酰肌醇-3,4,5-三磷酸(PIP3),而PIP3将BTK招募至细胞膜。值得注意的是,BTK主要表达于造血细胞(特别是B细胞),而不表达于T细胞或浆细胞。在BTK的下游,磷脂酶Cγ2(PLCγ2)被激活,从而导致Ca2+活化和PKC信号传导,进而NF-κB和ERK信号通路被激活,以促进恶性CLL细胞的增殖和存活(图3)。
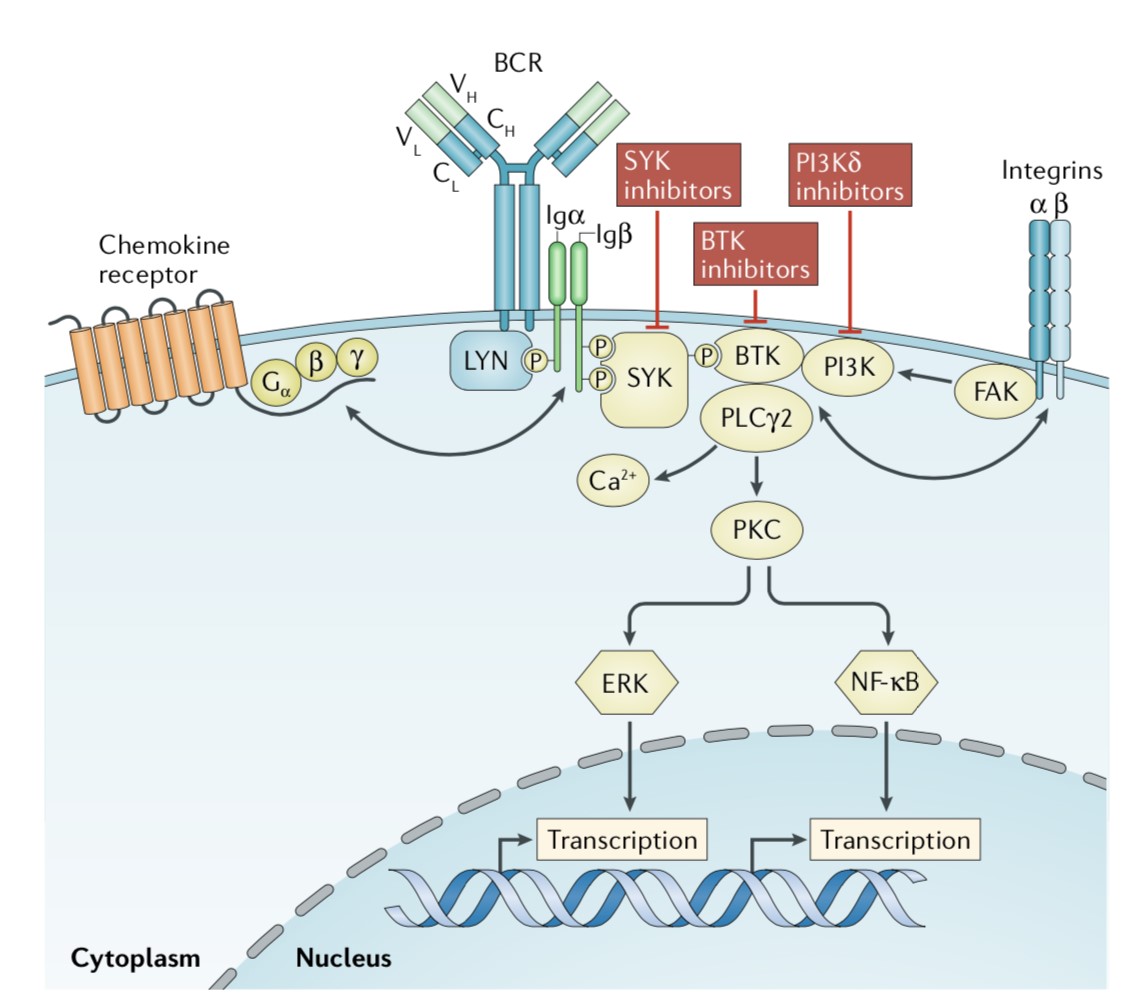
图3. CLL细胞中BCR介导的信号传导通路
靶向BCR治疗药物
伊布替尼作为不可逆BTKi,能够与BTK活性位点中的Cys481形成共价键。作为目前唯一被FDA批准用于治疗CLL的BTKi,伊布替尼在一线和复发/难治CLL患者中的效果显著。在临床试验中,伊布替尼对CLL、MCL、华氏巨球蛋白血症、边缘区淋巴瘤、ABC型弥漫性大B细胞淋巴瘤患者均有治疗作用。并且无论基因组风险因素或先前治疗方案如何,绝大多数CLL患者(94% after 44months)对伊布替尼均有响应。
伊布替尼相比于化学免疫疗法具有显著优势,而了解更多的伊布替尼长期治疗的安全性和有效性的更多信息,将有助于评估不同患者群体的预期获益和风险。近期发表在《BLOOD》上的伊布替尼II期研究5年长期随访中,研究人员对伊布替尼单药治疗17p染色体缺失或TP53突变及65岁以上患者的II期研究进行了5年长期随访,数据表明,对于大部分CLL患者,伊布替尼单药治疗能够达到持久的疾病控制。研究结果如下:
安全性
大多数血液学不良事件归因于疾病本身并随伊布替尼的使用而得到改善,多数非血液学不良事件为1或2级,3或4级非血液学不良事件有:感染(9.3%)、房颤(5.8%)、腹泻(3.5%)、皮疹(2.3%)和关节炎(2.3%)。任何级别的感染发生率为27.9%,值得注意的是,无论归因如何,感染的总体频率随着治疗时间的延长而下降,提示免疫功能得到改善。
反应性
在主要研究终点6个月时对81位患者的反应进行评估,所有患者的ORR 95.1%,完全缓解率(CR)在2年时为9.9%,3年时为21.0%,5年时达到28.4%。提示随着治疗的延续,患者完全缓解率逐步提高。
微小残留病灶(MRD)
通过流式细胞术在6个月和12个月发现,血液(PB)和骨髓(BM)中的CLL负荷(MRD)均显著降低;之后每年检测CLL瘤荷,发现血液及骨髓的肿瘤负荷分别以平均每年33%及25%的比例下降。服药3年及4年后别检测骨髓及外周血的MRD,发现同时间点骨髓及外周血MRD有显著相关性。值得注意的是, IGHV突变(M,mutated)患者的血液MRD显著高于IGHV未突变(U,unmutated)的患者(图4A),骨髓MRD水平在两者之间无显著差异(图4B)。根据3年时外周血MRD 10-2作为界值将患者分为两组:低MRD组(16 例,25%)和高MRD组(47 例,75%),两组间CR率无显著差异,而高MRD组(19.1%)较低MRD组(6.3%)似乎有较高的进展风险。
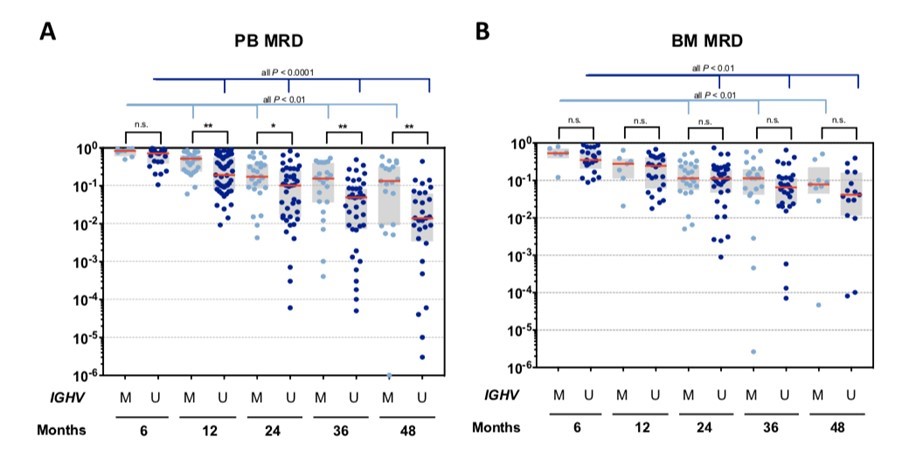
图4.血液(PB)和骨髓(BM)中的MRD随治疗时间推移的数据
研究结果-PFS、OS
中位随访57个月后,TP53队列中5年PFS为58.2%,老年队列为81.2%; TP53队列中位OS为75.7%,老年队列为83.8%。在两个队列中,PFS对接受伊布替尼作为一线治疗的患者更为有利。在TP53队列中,TN-CLL患者的5年PFS为74.4%,而RR-CLL患者为19.4%;TN-CLL患者的OS为85.3%,而RR-CLL患者为53.7%,两者均有统计学差异。在老年队列中,疾病进展或死亡事件未发生在TN-CLL组;RR-CLL组5年PFS为64.8%,OS为71.6%。此外,IGHV无突变及有突变组之间PFS和OS无统计学差异。
为提高CR和MRD阴性率,联合治疗是热门的研究方向,伊布替尼与抗CD20单克隆抗体,免疫化疗方案或venetoclax的联合这些随机试验正在进行中。而在伊布替尼治疗后MRD阴性患者中,有研究正在探索停药及维持治疗的远期复发。总体来看,伊布替尼治疗仍然是CLL患者在一线和复发/难治背景下的标准治疗方案。
CLL患者的治疗路径
随着新药出现,CLL患者治疗需根据预后因素进行个体化。低危患者中,免疫化学治疗FCR方案仍为年轻、体能状态好患者的标准一线治疗方案, BR 方案更加适合年龄>65 岁且体能状态良好的老年患者,而苯丁酸氮芥联合抗CD20单抗适用于老年有合并症、不能耐受强烈化疗的患者;低危患者中,BTKi(伊布替尼)被推荐用于年龄较大的一线治疗、耐药或者疾病进展出现时。对于具有高危预后因素(IGHV未突变、17p-、TP53突变、11q-)患者, BTKi(伊布替尼)为首选方案;由于BTKi可克服11q-和/或IgHV无突变对疾病的不良预后因素影响,而化学免疫治疗疗效差,因而此类患者为BTKi一线或复发难治的最佳适应症。BTKi耐药则应尝试PI3K抑制剂或BCL-2拮抗剂。(图5)。
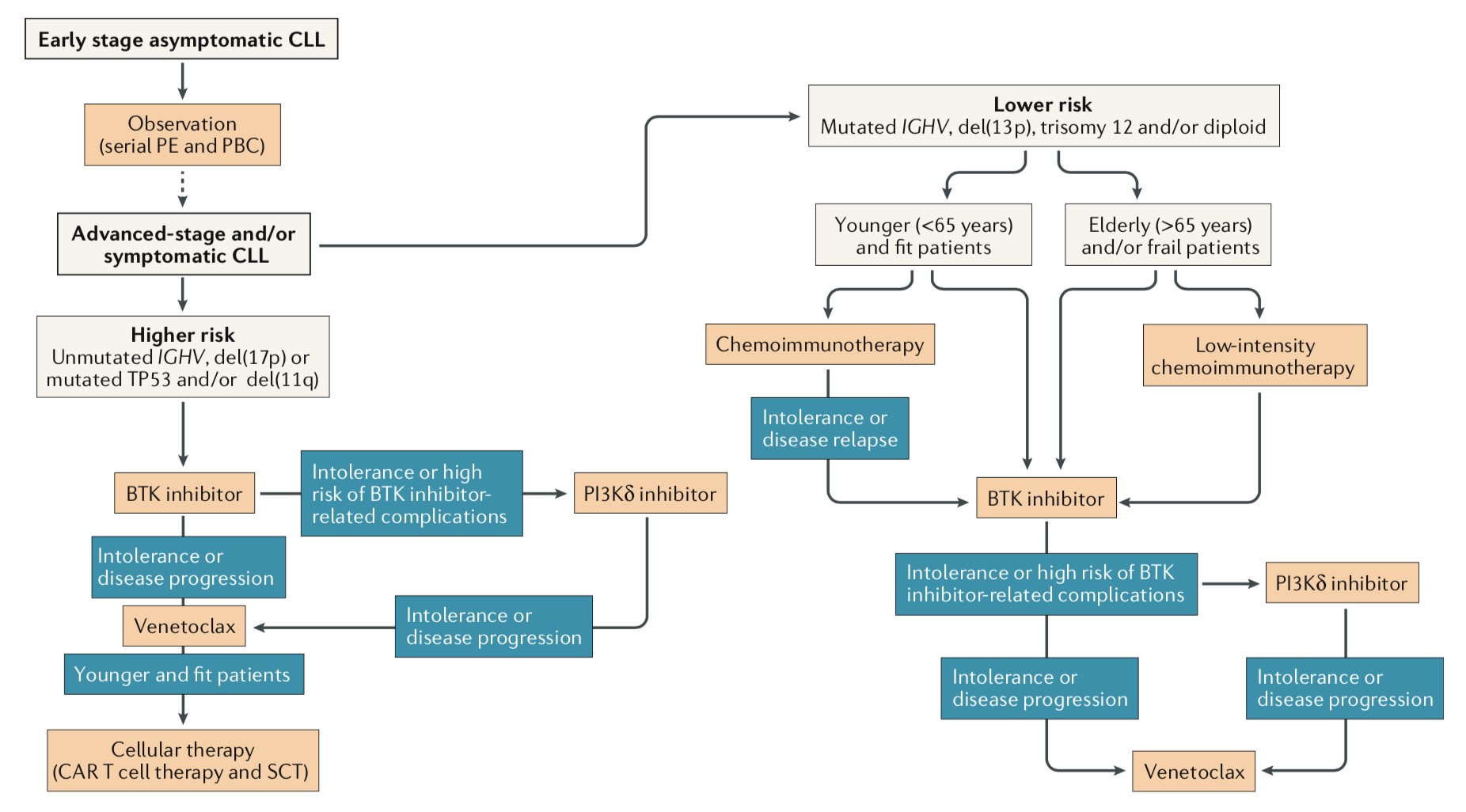
图5. CLL患者治疗路径
总结
过去5年内,一系列靶向治疗药物的上市彻底改变了CLL的治疗思维。虽然免疫化疗方案在2000年到2010年的十年之间是CLL的标准疗法,但随着新型靶向药物表现出对高风险患者及老年/体弱患者的显著有效性,免疫化疗的地位正在被撼动。特别是BTK、PI3Kδ和SYK抑制剂对于恶性B细胞的抑制,可以显著改善CLL患者的生存结果。未来面对的挑战将集中在如何解决治疗毒性、如何克服耐药发生,实现更深更持久的疾病缓解。
参考文献
Burger, Jan A., and Susan O’Brien. "Evolution of CLL treatment—from chemoimmunotherapy to targeted and individualized therapy." Nature Reviews Clinical Oncology (2018): 1.
如需了解更多淋巴瘤的前沿信息
请扫描二维码访问 “淋巴瘤亿刻 ”网站。

 热门推荐
MORE
热门推荐
MORE
J HEMATOL ONCOL:前瞻性研究预测伊布替尼治疗过程中房颤的发生
07-19
CANCER CHEMOTH PHARM :PH调节剂奥美拉唑对伊布替尼影响几何?
08-08
以数据为准绳,中国新药亟需更多原始创新!——首创BTK抑制剂伊布替尼原研专家潘峥婴专访
09-30
欧洲血液学杂志:TEC与BTK抑制剂出血副作用无关
10-22
2018年IWWM 会议现场直达:伊布替尼治疗华氏巨球蛋白血症突破性进展!
11-02
专家“亿”周谈—— J CLIN ONCOL:伊布替尼单药治疗症状型/初治型华氏巨球蛋白血症的最新突破
04-09
BLOOD:基于伊布替尼的联合方案治疗复发/难治CNS淋巴瘤效果显著
05-14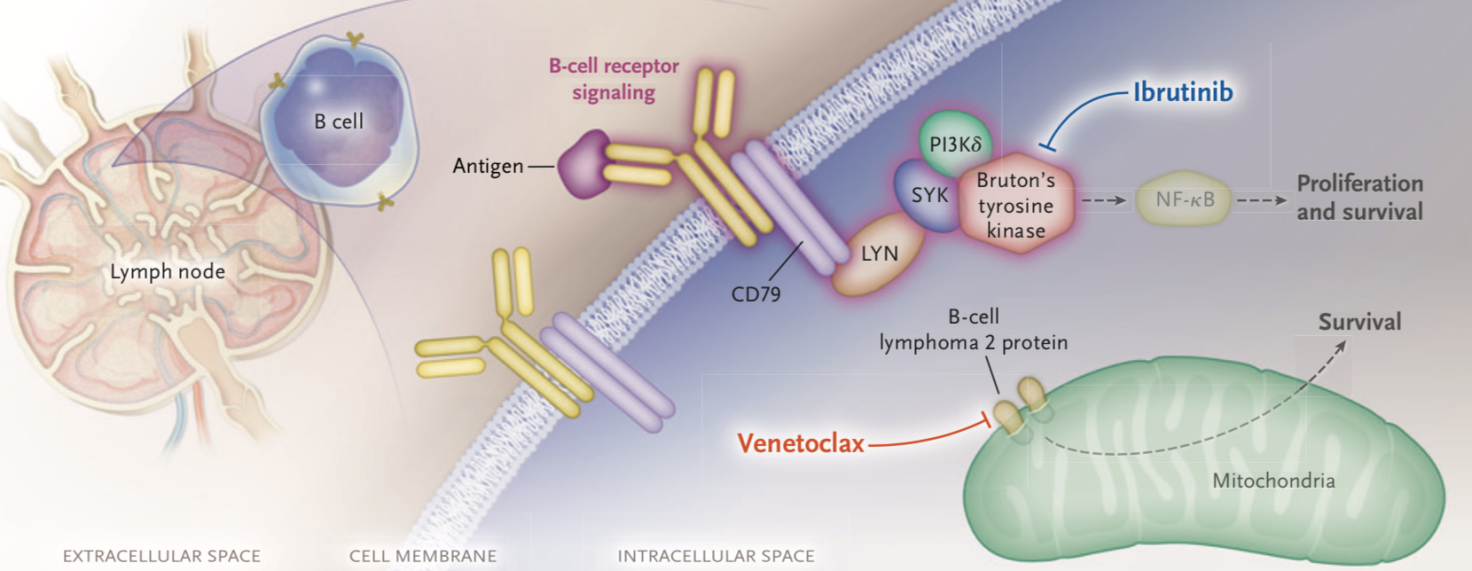
专家“亿”周谈——NEJM:伊布替尼联合维奈托克一线治疗慢性淋巴细胞白血病
06-12
【2019 ICML】黄慧强教授点评:IR联合短疗程R-HYPERCVAD / MTX在初治年轻MCL患者中有效性显著
06-20
【2019 EHA】纵览伊布替尼联合用药进一步提升CLL疗效
06-24
【2019 ICML】邱录贵教授点评:伊布替尼治疗华氏巨球蛋白血症的最新进展
06-25
【2019 ICML】张会来教授点评:伊布替尼联合利妥昔单抗治疗MCL疗效显著
06-25
【2019 ICML & EHA 回顾】中外专家畅谈伊布替尼治疗淋巴瘤的前沿进展
07-09Copyright 2008-2019 梅斯(MedSci)备案号 沪ICP备14018916号-1
