

背景介绍
回首过去十年,尽管以氟达拉滨+环磷酰胺+利妥昔单抗(FCR方案)为主的化学免疫疗法对慢性淋巴细胞白血病(CLL)的治疗取得了显著进展,但传统化学免疫疗法对具有高危预后因素的CLL患者的疗效往往不尽如人意,患者将面临的是更短的无进展生存期(PFS)和总生存期(OS)。目前已知的CLL高危预后因素除了大家所熟知的Del(17p)和TP53突变,外显子测序进一步表明SF3B1、NOTCH1、ATM和BIRC3突变也是CLL常见高危预后因素,特别是在复发难治CLL患者中,这些因素更加普遍存在。现有研究表明:TP53和SF3B1双重突变为PFS降低的危险因素;TP53突变为OS降低的危险因素;NOTCH1突变为抗CD20单克隆抗体耐药的危险因素并且与Richter转化(RT)风险增加相关。
相比于传统的非选择性细胞毒药物和化学免疫疗法,新型靶向性、细胞通路特异性抑制剂,如布鲁顿络氨酸激酶抑制剂(BTKi),磷脂酰肌醇3-激酶抑制剂(PI3Ki)和BCL2抑制剂(BCL2i)显著改善了高危CLL患者的生存结果。此外,嵌合抗原受体工程化T细胞(CAR-T细胞)作为一种新型靶向性细胞免疫疗法也在恶性B细胞肿瘤治疗中展现出了卓越疗效。面对这些新型治疗选择,全面汇总现有治疗手段的有效性和安全性相关数据,无论是对于临床医生还是患者而言都具有重要的指导意义。鉴于此,来自德国、英国、法国、西班牙、瑞典的临床专家全面总结了细胞通路抑制剂和细胞免疫疗法所取得的成果和面临的困境,同时为高危CLL患者治疗提出了建设性意见,相关最新综述近期发表于血液学权威杂志《BLOOD》。
一、细胞通路抑制剂
1. BTK抑制剂--伊布替尼
• 有效性
综合前期研究发现,复发/难治(R/R)CLL患者对伊布替尼单药治疗的总体反应率(ORR)非常好(80%-95%),10%左右的患者达到完全缓解(CR)和微小残留病灶(MRD)阴性。患者的两年无进展生存期(PFS)和总生存期(OS)分别为65%-80%和80%,并且如果将伊布替尼用作初治(TN)患者的一线治疗,即使在TP53异常的情况下,2年及以上的PFS率仍然> 85%。
• 安全性
导致停药的最主要的不良反应事件(AE)包括:感染、肺炎、房颤和出血事件,但是大多数为低级别不良反应,严重不良反应事件较少,并且伊布替尼治疗引起的自身免疫性溶血性贫血的风险很低。
• 预后因素
TP53基因的缺失和/或突变是目前被广泛接受的CLL预后指标。大多数TP53异常的患者对化学免疫疗法的反应差,但初诊CLL患者接受伊布替尼治疗的反应率不受TP53异常的影响(表2)。但是,TP53异常能够促进BTK或PLCg2突变的发展,进而赋予恶性肿瘤细胞对伊布替尼产生耐药。此外复杂核型(CK)已被视为新的影响预后的不利因素,虽然有数据显示CK在没有TP53异常的情况下,不影响患者对伊布替尼治疗的反应持续时间,但CK可能增加TP53异常对反应持续时间的不利影响。同时多项试验表明,剂量依从性似乎对伊布替尼治疗的成功与否至关重要。
近期及Brown, J. R其团队发表在Leukemia上的III期RESONATE研究扩展随访分析了经治高危CLL/SLL患者数据。研究证明,在许多具有高危预后因素的经治CLL患者中,与奥法木单抗组相比,伊布替尼组的PFS显著改善(图1a);包括Del(17p)(图1b)和Del(11q)在内的任何高危预后因素亚组中,伊布替尼组的中位PFS均显著高于奥法木单抗组。
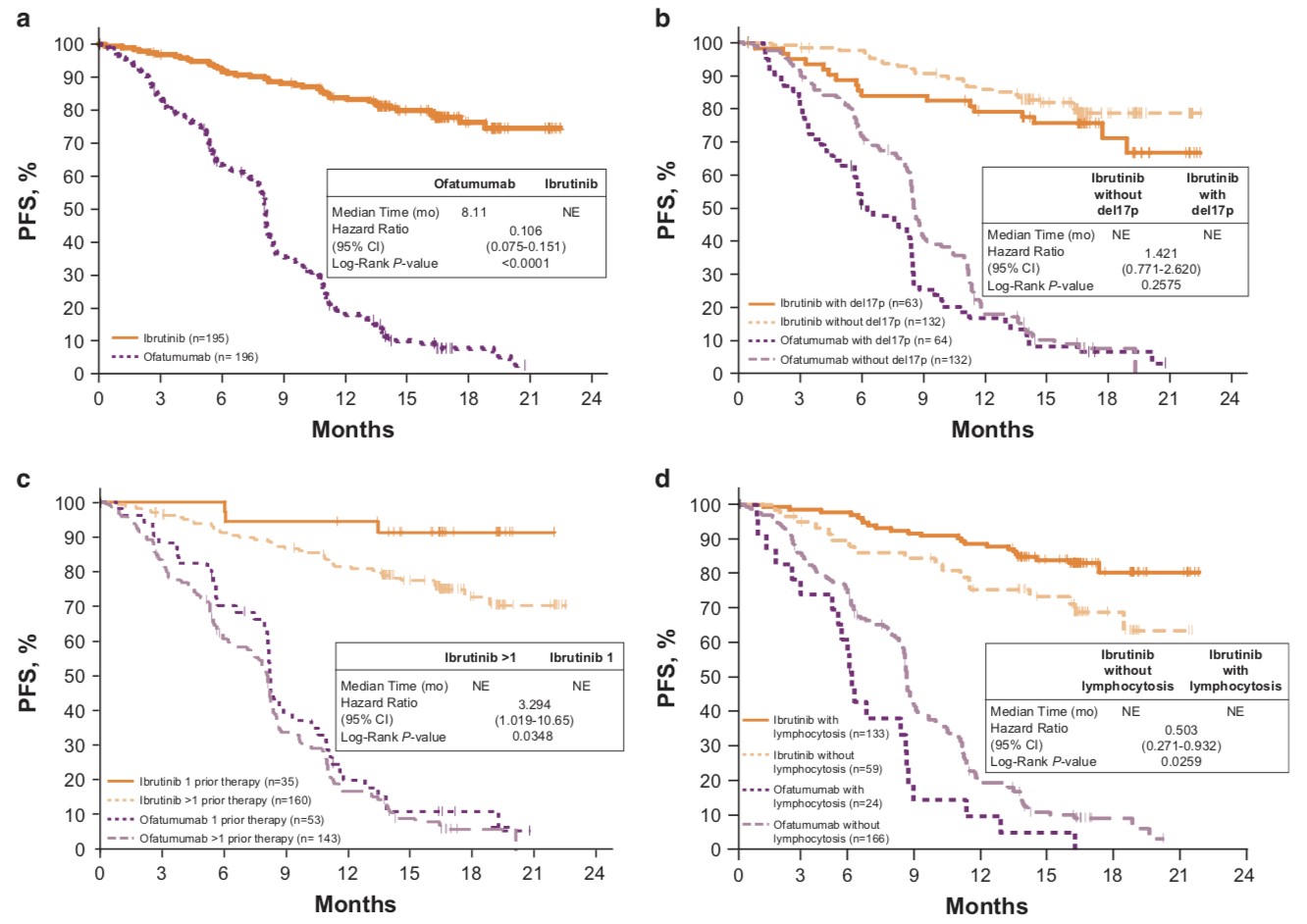
图1. 伊布替尼组与奥法木单抗组PFS数据:总体PFS(A);有无Del(17p)下的PFS(B);不同先前疗法数量下的PFS(C);有无淋巴细胞增多症下的PFS(D)
无论基线高危遗传因素(IGHV无突变,Del(17p),Del(11q),CK,NOTCH1突变,BIRC3突变和ATM突变)如何,在伊布替尼组中,18个月的PFS率均相似,且远高于奥法木单抗组的PFS数据。
相比于野生型患者,具有Del(17p)或Del(11q)CLL患者PFS类似(图2a);Del(17p)和/或TP53突变的患者与未有异常的患者相比,PFS无显著差异(图3a);然而,同时具有Del(17p)和TP53突变的患者(n = 38)的PFS较差(图2b);CK状态对伊布替尼治疗的PFS无显著影响(图3b)。在奥法木单抗组中,IGHV无突变和Del(11q)的存在具有较低的18个月PFS率;NOTCH1突变与总PFS较差相关。
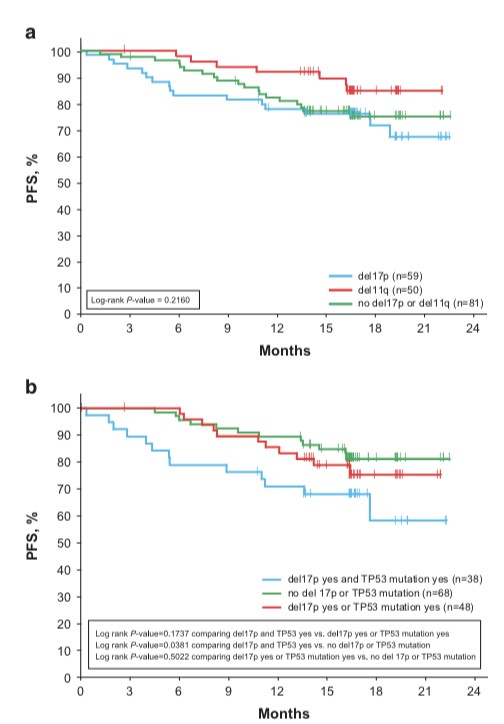
图2. 伊布替尼组中Del(17p)和Del(11q)亚组的PFS(A);Del(17p)和TP53突变亚组的PFS(B)
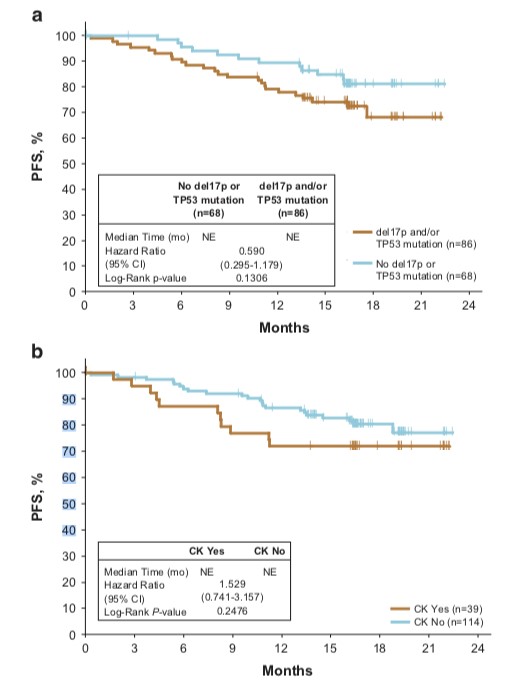
图3. 伊布替尼组中Del(17p)和TP53突变亚组的PFS(A);复杂核型(CK)亚组的PFS(B)
Del(17p)和/或TP53突变的患者与未有异常的患者相比,OS无显著差异(图4a);CK状态对伊布替尼治疗的OS无显著差异(图4b)。 伊布替尼组18个月OS为86%,Del(17p)亚组为83%,Del(11q)亚组为89%,两者无缺失亚组为85%,CK组为79%,这些数据均显著高于奥法木单抗组。
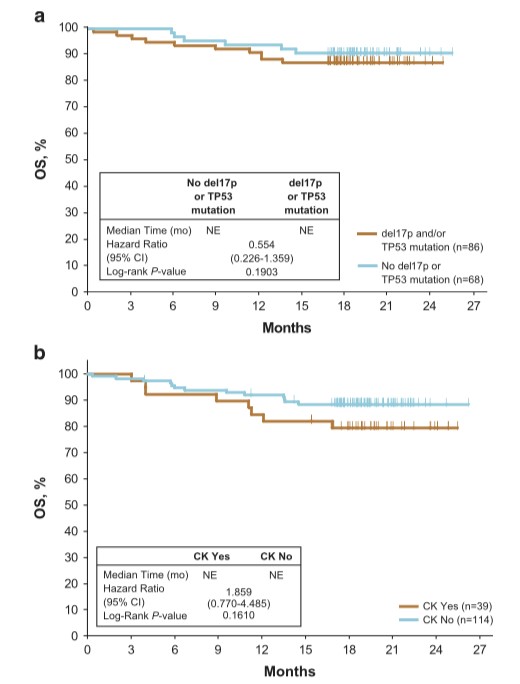
图4. 伊布替尼组中Del(17p)和TP53突变亚组的OS(A);复杂核型(CK)亚组的OS(B)
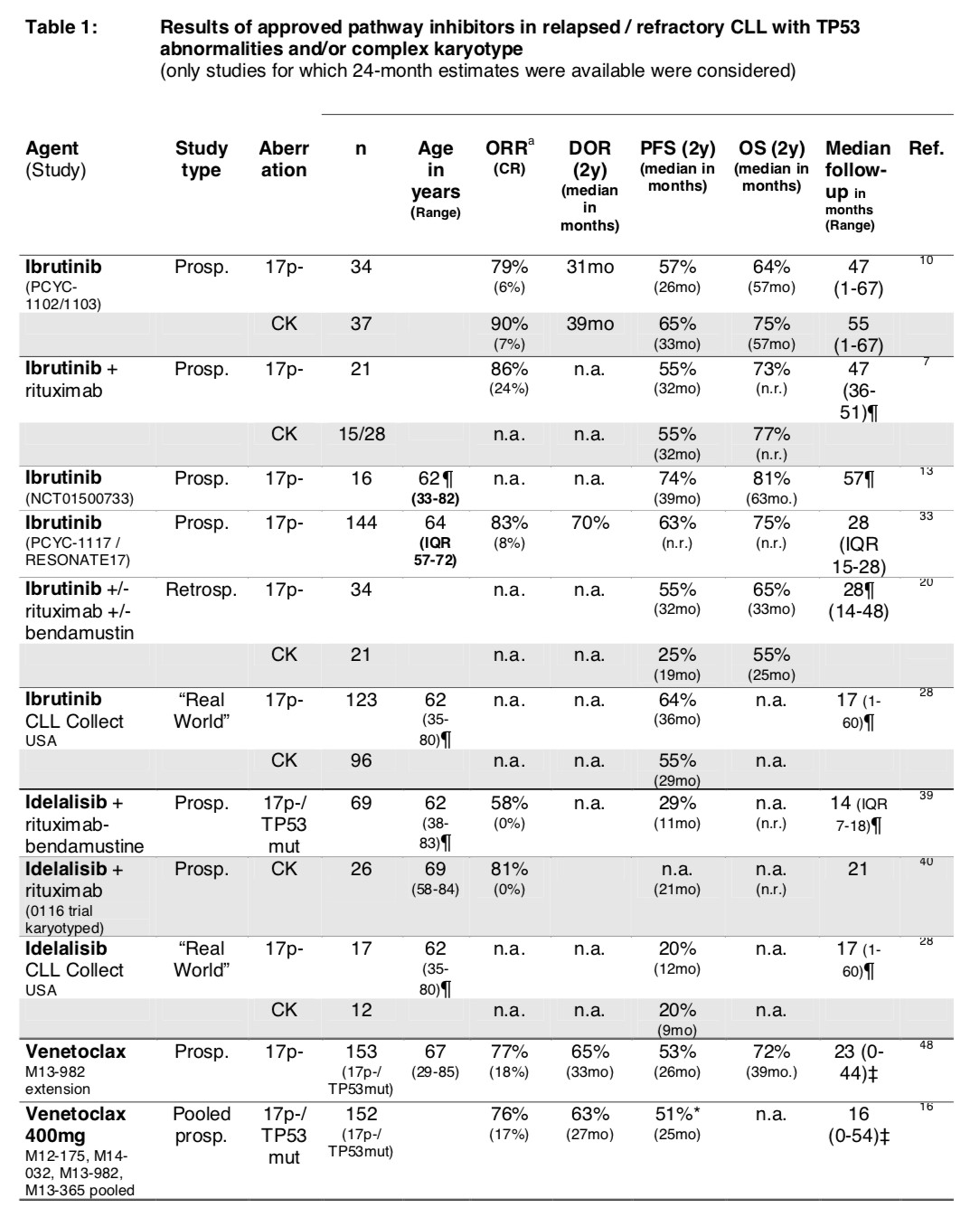
表1. TP53异常及CK的高危CLL患者经靶向性抑制剂治疗后的结果汇总
2.PI3K抑制剂--艾代拉里斯
• 有效性
艾代拉里斯(Idelalisib)是一种PI3K-delta抑制剂,通常与利妥昔单抗或奥达木单抗联合使用治疗CLL。对于R/R CLL患者,艾代拉里斯联合治疗的反应率与伊布替尼相似,但中位PFS较短(通常<2年)。
• 安全性
经艾代拉里斯治疗的R/R CLL患者最常见的≥3级毒性包括感染和自身免疫介导的炎症,如肠炎/腹泻(20%)、肺炎(5%),此外,机会性感染也经常发生。初步分析表明,在R/R CLL患者中,艾代拉里斯疗法发生致死性AE的风险大于10%。
• 预后因素
初步数据表明TP53异常和CK不会显著影响治疗结局,但是由于中位PFS较短(通常<2年),对TP53缺失的患者而言伊布替尼要优于艾代拉里斯(表1)。
3.BCL2抑制剂--维奈托克
• 有效性
维奈托克(Venetoclax)是一种BCL2抑制剂,适用于化学免疫疗法和BTKi或PI3Ki治疗都失败的患者。虽然维奈托克的ORR(70%-80%)并不优于BTKi/PI3Ki,但相当多的患者(20%-30%)在R/R情况下仍能达到CR甚至MRD阴性,如果维奈托克与利妥昔单抗联用可能会进一步增加治疗获益。
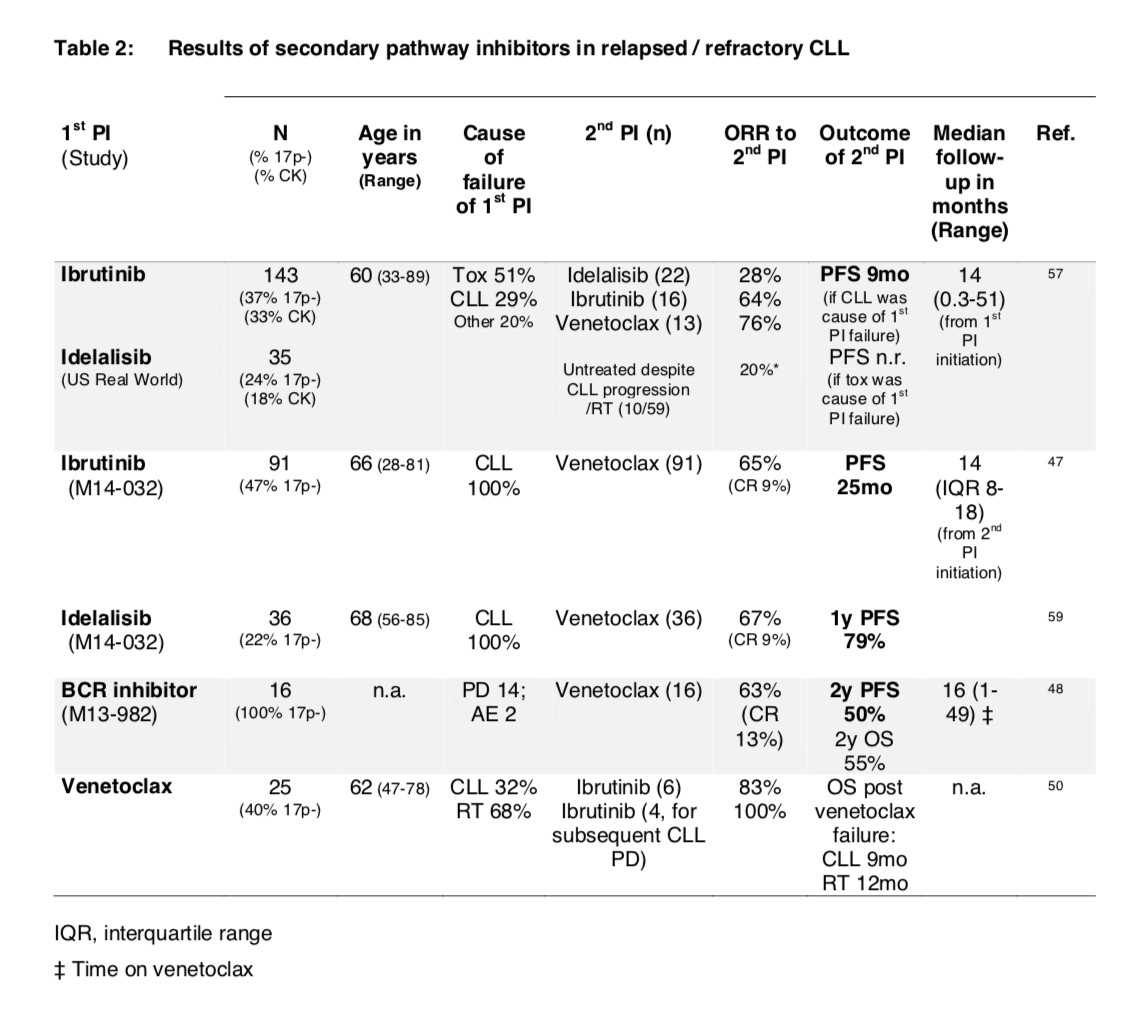
表2. 二级靶向性药物治疗结果汇总
• 安全性
对于维奈托克治疗,3/4级中性粒细胞减少症和血栓形成率分别高达40%和15%。此外,在维奈托克治疗期间可能发生严重感染,但在已发表的试验中,致命性AE发生率低于5%。
• 预后因素
对于TP53异常的患者,与伊布替尼相似的是,维奈托克表现出高反应率但持续缓解时间下降(表1)。在回顾性分析中,TP53异常、CK和先前治疗失败与维奈托克治疗获得较短的PFS显著相关。更为关键的是,突变驱动的维奈托克抗性表明克隆进化的复杂模式。
细胞通路抑制剂面临的困境及解决方案
CLL进展和RT是细胞通路抑制剂治疗面临的主要问题。由于细胞通路抑制剂的内在作用,如果触发B细胞基因组的不稳定性,RT转化将更有可能发生。目前探索早期使用细胞通路抑制剂组合的方法似乎是有希望的,此外,细胞通路抑制剂的长期毒性也需要仔细评估,特别是针对可能引发B细胞基因组不稳定性的药物。
二、细胞免疫疗法
1. 异基因造血细胞移植
• 有效性
异基因造血细胞移植(alloHCT)的基本原则是在患者体内建立外源免疫系统,永久抑制或根除恶性受体淋巴细胞的生成,这种效应称为移植物抗白血病活性(GVL)。在前瞻性CLL3X试验中,alloHCT治疗后,10年复发风险仅有12%,GVL介导的MRD阴性患者5年后复发率仅为6%。AlloHCT治疗的2年PFS和OS率分别为50%-60%和60%-75%;5年PFS和OS率分别为61-67%,45%-65%;长期随访研究报告称10年PFS约为30%。
• 安全性
使用现代移植策略,alloHCT后100天内的死亡率小于5%,然而移植两年后非复发死亡率(NRM)可能增加到40%。除了NRM外,alloHCT后生活质量(QOL)的下降也是主要预后因素,大约25% 的患者在第一次移植后生活质量受损。此外,同种异体移植的患者死亡、感染和住院的风险更高。
• 预后因素
除了疾病相关的风险因素外,程序相关变量,如年龄、性别不匹配、供体类型、表现状态(PS)、T细胞耗竭(TCD)等都是alloHCT的预后因素。
2. CAR-T细胞疗法
• 有效性、安全性及预后因素
AlloHCT的GVL效应依赖于针对多种未定义的多克隆免疫反应靶向抗原,而CAR-T细胞发挥针对确定的抗原的单克隆免疫活性。然而,CLL中CAR-T细胞应用研究的数量有限,宾夕法尼亚大学的研究人员治疗了14例重度治疗的R/R CLL患者,其中43%伴有TP53异常,经CAR-T细胞治疗后,29%的患者取得CR,1例CR患者死于感染,18个月总体PFS率为29%。Fred Hutchison癌症研究中心发表了一项CAR-T治疗24例伊布替尼治疗失败的R/R CLL患者的研究,结果显示,74%的患者对治疗产生了反应,7例患者达到MRD阴性。
总之,CAR-T细胞疗法似乎在CLL中具有相当大的治疗潜力,对alloHCT、化学免疫疗法和靶向性抑制剂治疗后复发的患者仍然有效。然而,我们需要进一步的研究和更长的随访以确定MRD阴性率。
细胞免疫疗法面临的困境及解决方案
细胞通路特异性抑制剂的出现,特别是伊布替尼,显著改善了高危CLL的治疗预后。最近的数据表明同种异体移植后给予伊布替尼治疗的安全性和有效性(表3)。此外,伊布替尼还可能会增强Th1介导的GVL效应。因此,伊布替尼的出现使移植后复发的CLL患者的治疗结果有了很大改善。
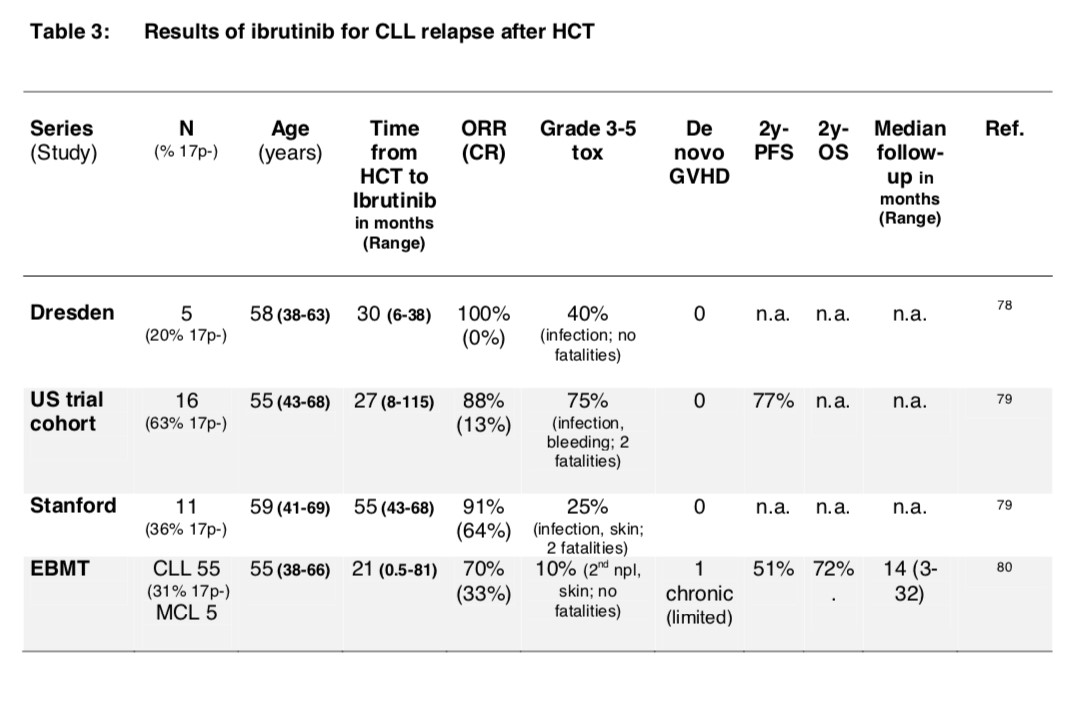
表3. alloHCT治疗后使用伊布替尼治疗的结果汇总
总结
对于高危CLL患者,细胞通路特异性抑制剂应逐渐成为标准疗法。在缺乏对不同特异性抑制剂的随机头对头比较时,药物的选择应取决于不同抑制剂的可及性、有效性、安全性和个体风险。为了取得更大的治疗收益,则必须综合考虑:(1)NRM风险;(2)复发风险;(3)转化及耐药风险;(4)长期疾病控制和生存机会。特别是alloHCT,年龄较小(≤65岁)且没有合并症的患者适于进行alloHCT,相反,风险较高(高龄且存在合并症)的患者可能更适于继续使用特异性抑制剂治疗(图1)。
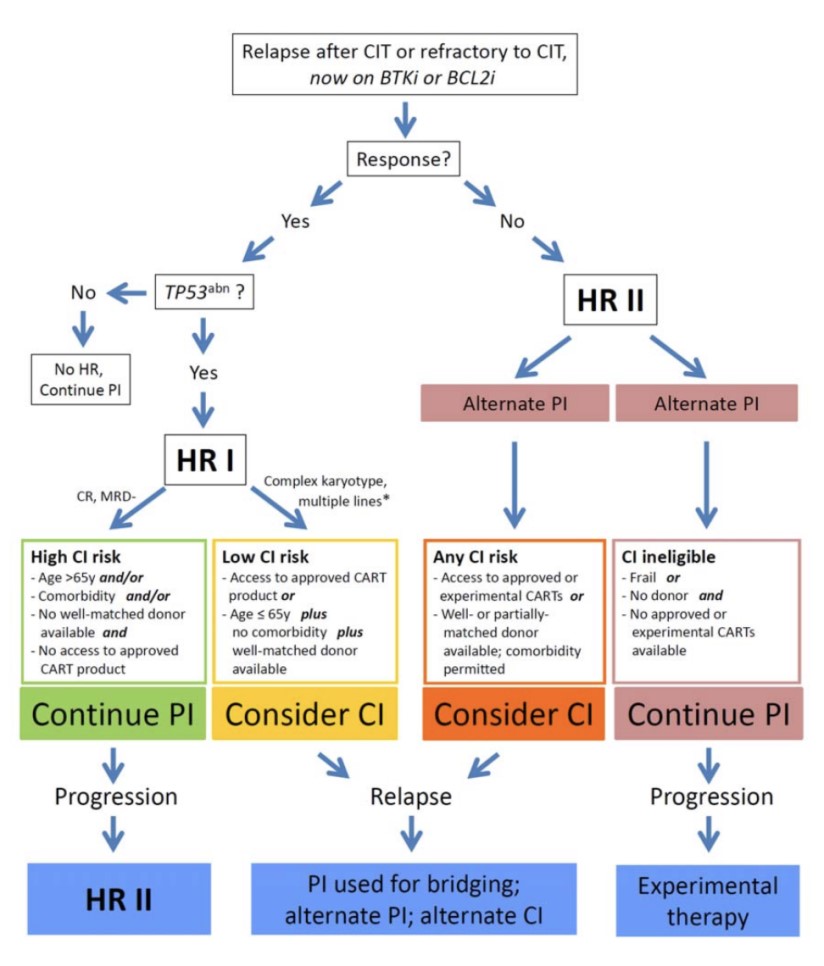
图5. 依据不良预后因素制定的治疗流程
参考文献
[1] Dreger, Peter, et al. "High-risk chronic lymphocytic leukemia in the era of pathway inhibitors: Integrating molecular and cellular therapies." Blood (2018): blood-2018.
[2] Brown, J. R., et al. "Extended follow-up and impact of high-risk prognostic factors from the phase 3 RESONATE study in patients with previously treated CLL/SLL." Leukemia 32.1 (2018): 83.
如需了解更多淋巴瘤的前沿信息
请扫描二维码访问 “淋巴瘤亿刻 ”网站。

 热门推荐
MORE
热门推荐
MORE

专家“亿”周谈——直击伊布替尼,纵观CLL治疗从免疫化疗到个体化靶向疗法的革新
07-09
J HEMATOL ONCOL:前瞻性研究预测伊布替尼治疗过程中房颤的发生
07-19
CANCER CHEMOTH PHARM :PH调节剂奥美拉唑对伊布替尼影响几何?
08-08
以数据为准绳,中国新药亟需更多原始创新!——首创BTK抑制剂伊布替尼原研专家潘峥婴专访
09-30
欧洲血液学杂志:TEC与BTK抑制剂出血副作用无关
10-22
2018年IWWM 会议现场直达:伊布替尼治疗华氏巨球蛋白血症突破性进展!
11-02
专家“亿”周谈—— J CLIN ONCOL:伊布替尼单药治疗症状型/初治型华氏巨球蛋白血症的最新突破
04-09
BLOOD:基于伊布替尼的联合方案治疗复发/难治CNS淋巴瘤效果显著
05-14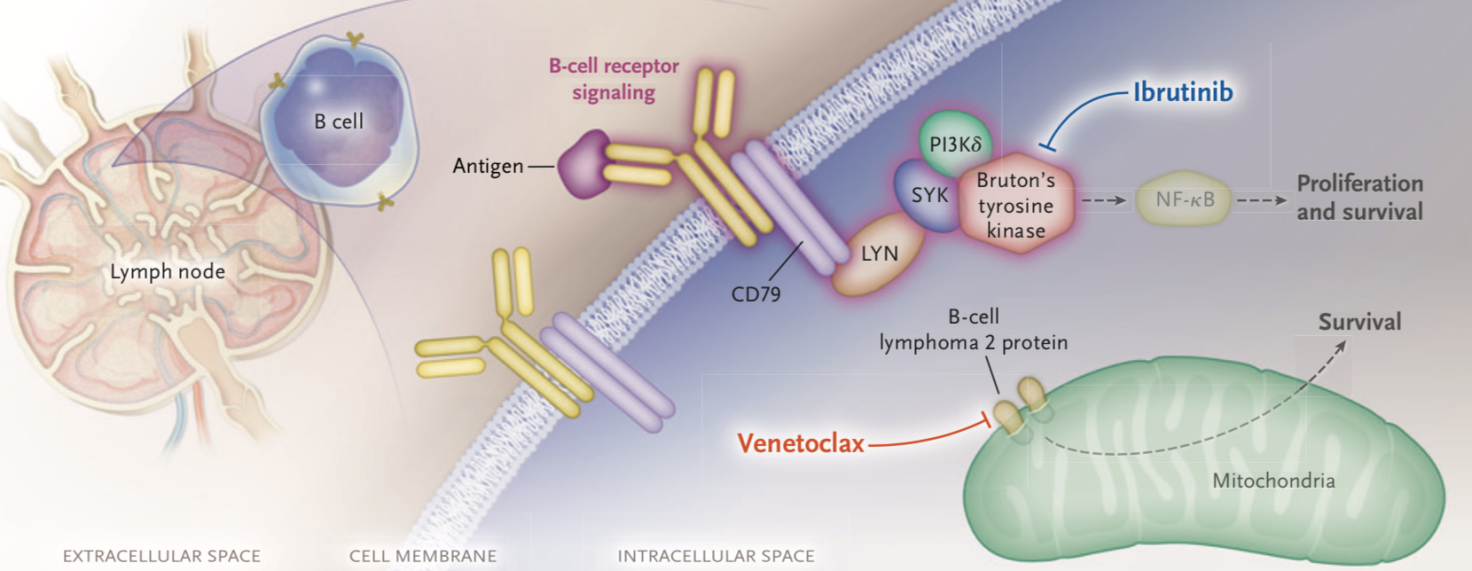
专家“亿”周谈——NEJM:伊布替尼联合维奈托克一线治疗慢性淋巴细胞白血病
06-12
【2019 ICML】黄慧强教授点评:IR联合短疗程R-HYPERCVAD / MTX在初治年轻MCL患者中有效性显著
06-20
【2019 EHA】纵览伊布替尼联合用药进一步提升CLL疗效
06-24
【2019 ICML】邱录贵教授点评:伊布替尼治疗华氏巨球蛋白血症的最新进展
06-25
【2019 ICML】张会来教授点评:伊布替尼联合利妥昔单抗治疗MCL疗效显著
06-25
【2019 ICML & EHA 回顾】中外专家畅谈伊布替尼治疗淋巴瘤的前沿进展
07-09Copyright 2008-2019 梅斯(MedSci)备案号 沪ICP备14018916号-1
